
Г. А. Пьявченко1,3, П. Дутта3, Н. С. Новикова2, В. А. Пугач2, Е. А. Корнева2, В. И. Ноздрин1, 3
1Центр доклинических исследований (руководитель – к.б.н. Г. В. Трунова), АО «Ретиноиды», г. Москва, Россия;
2Отдел общей патологии и патофизиологии (заведующая – д.б.н. О. В. Шамова), ФГБНУ «ИЭМ», г. Санкт-Петербург, Россия;
3Кафедра гистологии, цитологии и эмбриологии (заведующий – д.м.н., проф. В. И. Ноздрин), Медицинский институт ФГБОУ ВО «ОГУ имени И. С. Тургенева», г. Орёл, Россия.
В опыте на 2-х месячных крысах-самцах линии Sprague Dawley показано, что местное накожное нанесение антисептика-стимулятора Дорогова (АСД) в низких дозах (0,5 г/кг/сут) в течение 1 недели сопровождается повышением двигательной и ультразвуковой активности животных. Эффект сопровождался увеличением содержания активированных, c-Fos-позитивных, нейронов цингулярной, моторной, инсулярной, пириформной коры и стриатума головного мозга.
Ключевые слова: АСД, c-Fos, кора, стриатум, Laboras, Sonotrack
Адрес для корреспонденции: gennadii.piavchenko@yandex.ru Пьявченко Г. А.
Обнаруженный в ранее проведенных исследованиях эффект АСД в дозе 4 г/кг/сут продемонстрировал выраженную активацию нейронов многих участков головного мозга, которая коррелировала с увеличением поведенческой активности крыс [5].
Целью настоящего исследования явилось изучение влияния накожного нанесения АСД в низкой дозе (0,5 г/кг/сут) на функциональную активацию нейронов коры и стриатума головного мозга крыс.
Опыт был поставлен на крысах-самцах линии Sprague Dawley (100-120 г, n=6 в группе) возрастом 2 месяца, полученных из питомника ФИБХ РАН «Пущино». Животных содержали в контролируемых по температуре, влажности, освещенности и бактериальной чистоте условиях вивария Центра доклинических исследований АО «Ретиноиды» (ЦДИ) [4]. Исследование проводили в соответствии с основными принципами надлежащей лабораторной практики [3] согласно утвержденному плану исследования, заключению комиссии по этике АО «Ретиноиды» и стандартным операционным процедурам ЦДИ. После двухнедельного карантина и заключения ветеринарного врача о допуске животных рандомизировали в 3 группы: 1 группа – интактные животные, 2 группа – животные, получавшие основу препарата, 3 группа – животные, получавшие 5% АСД на выстриженную поверхность кожи межлопаточной области спины площадью 4 см2 в дозе 0,5 г/кг/сут в вечерние часы в течение 1 недели. После этого осуществляли запись поведенческих реакций на комплексах Laboras и Sonotrack (Metris, Нидерланды). На основе полученных данных изучали двигательную активность и параметры ультразвуковых вокализаций (УЗВ) животных. Затем животных наркотизировали препаратом Золетил 100 (Vibrac, Франция) и после интракардиальной перфузии иммунофикса (Bio-Optica, Италия) на замороженных срезах толщиной 40 µm выявляли экспрессию c-Fos-гена авидин-биотиновым методом с детекцией 3,3’-диаминобензидином. Участки мозга на 13-17 уровнях срезов идентифицировали по атласу Paxinos and Watson [8] и осуществляли подсчет c-Fos-позитивных нейронов с помощью светового микроскопа Axioscop 2 (Carl Zeiss, Германия), камеры AxioCam и программного обеспечения AxioVision (об. 40, ок. 20). Статистический анализ проводили с использованием программного пакета Statistica 6.1. Достоверность отличий данных между группами оценивали с применением t-критерия Стьюдента. Различия считали достоверными при P≤0,05.
Анализ двигательной активности показал, что животные, получавшие препарат, отмечают достоверное повышение продолжительности двигательных актов, скорости передвижения, пройденного расстояния и общего количества поведенческих актов (Таблица 1).
| Группы | Продолжительность двигательных актов, сек | Средняя скорость движения, мм/с | Пройденное расстояние, м | Общее количество поведенческих актов |
|---|---|---|---|---|
| Интактные животные | 5,3±2,4 | 0,3±0,1 | 0,2±0,1 | 128±35,9 |
| Животные, получавшие основу | 27,2±3,1* | 2,4±0,2* | 2,1±0,3* | 298,3±24,1* |
| Животные, получавшие препарат | 97,6±9,9*,# | 4,1±0,5*,# | 4,9±0,3*,# | 457,8±16,4*,# |
* P≤0,05, по сравнению с интактными животными.
*,# P≤0,05, по сравнению с животными, получавшими основу препарата.
Данные по ультразвуковым вокализациям лабораторных животных также свидетельствуют об увеличении поведенческой активности в группе, получавшей препарат (Таблица 2).
| Группы | Число криков | Число надпороговых криков | Средняя частота, кГц |
|---|---|---|---|
| Интактные животные | 4,2±2,2 | 0 | 49,1±0,04 |
| Животные, получавшие основу | 7,1±2,3 | 1,4±0,3* | 49,2±0,12 |
| Животные, получавшие препарат | 79,7±4,9*,# | 6±1,2*,# | 49,1±0,06 |
* P≤0,05, по сравнению с интактными животными.
*,# P≤0,05, по сравнению с животными, получавшими основу препарата.
Животные, получавшие препарат в дозе 0,5 г/кг, продемонстрировали более высокую степень активации (по числу c-Fos-позитивных нейронов) цингулярной, моторной, инсулярной и пириформной коре, а также – в стриатуме (Таблица 3). Наибольшая нейрональная активация отмечалась в моторной коре и стриатуме (Рисунок).
| Зоны головного мозга | Группы | ||
|---|---|---|---|
| Интактные животные | Животные, получавшие основу | Животные, получавшие препарат | |
| Цингулярная кора | 0,8±0,1 | 3,4±0,2* | 13,4±0,3*,# |
| Моторная кора | 2,7±0,2 | 9,0±0,6* | 40,3±1,4*,# |
| Сенсорная кора | 4,6±0,2 | 9,8±0,4* | 10,9±0,5* |
| Инсулярная кора | 0 | 0 | 19,0±0,4*,# |
| Пириформная кора | 0 | 3,6±0,2* | 19,1±0,7*,# |
| Стриатум | 0,6±0,1 | 2,6±0,3* | 24,3±0,5*,# |
* P≤0,05, по сравнению с интактными животными.
*,# P≤0,05, по сравнению с животными, получавшими основу препарата.
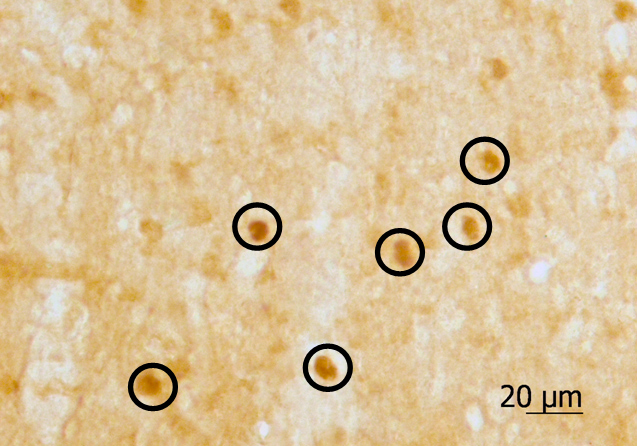
A
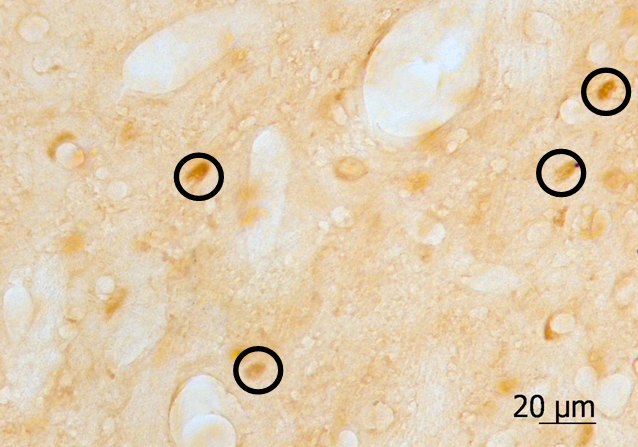
B
Рисунок. Фрагменты моторной коры (A) и стриатума (B) крыс, получавших 5% АСД. C-Fos-позитивные нейроны (примеры клеток – в овалах). Об. 40х, ок. 20х.
Антисептик-стимулятор Дорогова оказался эффективным средством в лечении таких кожных заболеваний, как атопический дерматит, экзема, нейродермит и др. [1]. Являясь субстанцией для наружного применения, он содержит большое количество органических веществ. Эффективной лечебной формой является 5% АСД [1]. Такая концентрация позволяет добиться позитивных терапевтических результатов и избежать сильных раздражений кожи.
Ранее проведенное исследование выявило нарастание функциональной активности и количества нейронов коры головного мозга крыс по мере взросления от молодых особей к взрослым, и постепенное уменьшение этих показателей к старости [6]. Обращая внимание на структурно-функциональную реорганизацию коры головного мозга у 1 месячных животных, для исследования были выбраны крысы в возрасте 2-х месяцев. В другом исследовании нами было показано, что накожное нанесение препарата с АСД в высоких дозах (4 г/кг/сут) в течение 1 недели повышает УЗВ и двигательную активность у крыс-самцов в возрасте 2-х месяцев. Эти показатели достоверно коррелировали с количеством активированных нейронов цингулярной, моторной, соматосенсорной, инсулярной, пириформной коры и стриатума головного мозга [5].
В настоящем исследовании накожное нанесение препарата в 8 раз меньшей дозе вызывало функциональные и морфологические изменения реактивности тех же структур, однако количество c-Fos-позитивных клеток выявлялось больше в моторной коре и стриатуме, а также пириформной и инсулярной коре, в то время как увеличение количества активированных нейронов в цингулярной и соматосенсорной коре было менее выраженным. Изменения в показателях двигательной и УЗВ активности продемонстрировали увеличение количества поведенческих актов. При этом средняя скорость передвижения и пройденное расстояние, а также количество надпороговых криков увеличилось меньше в сравнении с более высокой дозой препарата. Менее выраженная активация нейронов цингулярной коры, ответственной за сложные поведенческие и ультразвуковые реакции [9], отражает полученные физиологические данные. Отсутствие достоверных различий количества активированных клеток соматосенсорной коры в 2 и 3 группах исследования позволяет предположить незначительность факта неприятных (раздражающих, болевых и др.) ощущений от нанесения препарата.
Сходные данные были получены и другими авторами. Так в исследовании Sayin A. и др. [10], которые показали, что эстральный цикл у крыс сопровождается выявленным на приборах Laboras и Sonotrack повышением состояния тревожности и УЗВ активности, коррелирующих с увеличением количества c-Fos-позитивных нейронов в цингулярной коре и других структурах мозга, а введение антидепрессанта циталопрама все эти показатели снижает. Babaev O. и соавт. [7] в своей работе отмечали факт нарастания тревожного поведения и активации тревого-ассоциированных нейронов (c-Fos-позитивных) в участках мозга при деактивации белка нейролигина 2, играющего ключевую роль в активации ингибиторных синапсов мозга. Изменения содержания c-Fos-позитивных нейронов описано Ивашкиной О. И. и др. [2] в процессе обучения лабораторных мышей рефлексу замирания.
Таким образом, накожное нанесение крысам АСД в малых дозах вызывает повышение двигательной и УЗВ активности, сопровождающееся увеличением количества c-Fos-позитивных нейронов цингулярной, моторной, инсулярной, пириформной коры и стриатума без увеличения активации соматосенсорной коры.
Не забудьте вступить в наши группы в социальных сетях!