
Л.В. Силина1,
Ю.Е. Харахордина1,
Е.А. Есипова1,
А.В. Карпова2
1 – ФГБОУ ВО КГМУ Минздрава РФ, Курск, Россия;
2 – АО «Ретиноиды», Москва, Россия;
Актуальность: кератодермии вследствие хронического прогредиентного течения формируют у пациентов физический и психоэмоциональный дискомфорт, торпидность и резистентность патологического процесса диктуют необходимость совершенствования системного и местного лечения.
Цель исследования – оценка клинической эффективности, обоснование целесообразности применения и перспектив использования в комбинированной терапии кератодермий «Ретинола пальмитата», мазей «Радевит® Актив» и «Уродерм».
Материалы и методы: из 80 пациентов были сформированы четыре группы. Пациенты 1-й группы получали стандартную терапию. Больные 2–4-й групп – терапевтические дозы «Ретинола пальмитата» в течение двух месяцев, затем поддерживающие – наружно мази «Уродерм» и «Радевит® Актив» 1 месяц.
Результаты. Выраженность воспалительного процесса в 1-й группе уменьшилась в 4 раза, во 2-й – в 10 раз, в 3-й и 4-й – полностью нивелировалась. Зуд кожи отсутствовал у больных 2-й – 4-й групп. Средний балл лечения в 1-й группе был неудовлетворительным, во 2-й группе – удовлетворительным, в 3-й и 4-й – хорошим, хотя в 4-й группе наблюдались аллергические реакции. Положительный эффект терапии сохранялся в 1-й группе 2 недели, во 2-й – 1 месяц, в 3-й и 4-й –2 месяца. Уровень рецидивов в 1-й и 2-й группах исследования был выраженным, в 3-й и 4-й – умеренным. Пациенты 1-й группы отмечали некоторое улучшение качества жизни, 2-й группы – удовлетворительное состояние, в 3-й и 4-й показатели дерматологический индекс качества жизни были высокими.
Обсуждение. У пациентов 2–4-й групп были установлены выраженное и быстрое нивелирование клинической картины, длительный межрецидивный период и слабые обострения. Препараты обладали высокими показателями безопасности и переносимости. Максимально эффективной, без побочных эффектов была признана терапия с использованием «Ретинола пальмитата» в дозе 200 000 МЕ в сутки (60 капель) первые 2 месяца, затем 130 000 МЕ (40 капель) – 1 месяц.
Ключевые слова: кератодермия, «Ретинола пальмитат», мазь «Уродерм», мазь «Радевит® Актив»
Ладонно-подошвенные кератодермии представляют собой группу болезней наследственного или приобретенного характера, в клинической картине которых присутствуют диффузные или очаговые утолщения рогового слоя эпидермиса преимущественно в области ладоней и подошв, реже в сочетании с кератозами другой локализации [1–3]. Данная патология, являясь одной из наиболее распространенных среди дискератозов, занимает второе место в структуре наследственных заболеваний кожи. Заболевание чаще встречается у женщин, наследственная отягощенность колеблется от 1:1000 до 1:4000–9000 [5].
По происхождению различают наследственные и приобретенные кератодермии. Наследственные кератодермии обусловлены мутациями в генах, кодирующих образование кератина и белков клеточной оболочки. Они могут быть самостоятельными заболеваниями или сочетаться с разнообразными аномалиями, чаще всего эктодермального происхождения [1, 6]. В практике врача-дерматовенеролога довольно часто встречаются пациенты с приобретенными формами ладонно-подошвенных кератодермий, возникающими на фоне основного заболевания или вследствие внешних триггеров. Они сопровождают такие дерматозы, как красный волосяной лишай Девержи, красный плоский лишай, экзема, псориаз, ихтиоз. Кератодермии встречаются и при инфекционных заболеваниях – вторичном сифилисе, гонорейном кератозе, при синдроме Рейтера, дерматомикозах, норвежской чесотке, а также при нарушениях функции нервной и эндокринной систем (гипотиреоз, микседема), метаболических нарушениях, беременности, менопаузе [8]. Кератодермии могут быть маркерами паранеопластических процессов во внутренних органах. Описаны случаи, когда кератодермия сочеталась с такими онкологическими заболеваниями, как рак пищевода или желудка, когда развивается параонкологический кератоз ладоней и подошв. Возможно развитие профессиональных кератодермий, возникающих под воздействием лучевых, химических и механических факторов [9, 10].
По клиническим признакам выделяют две основные группы кератодермий – диффузные, при которых наблюдается сплошное поражение поверхностей ладоней и подошв, и очаговые, когда участки избыточного ороговения располагаются островками, линейно, точечно, а не распространяются на всю поверхность [11].
Все ладонно-подошвенные кератодермии, несмотря на многообразие клинических форм, имеют общие гистологические признаки: значительный гиперкератоз, реже акантоз, и мононуклеарная инфильтрация верхнего слоя дермы, преимущественно вокруг кровеносных сосудов [18]. Ладонно-подошвенные кератодермии наследственного характера также имеют общие гистологические признаки. Характерна эктодермальная дисплазия и воспаление, акантоз, гиперкератоз, иногда очаговый паракератоз. Встречаются небольшие периваскулярные инфильтраты в верхней части дермы. Гиперкератоз и гранулез отмечаются при подавляющем большинстве диффузных и ограниченных форм ладонно-подошвенных кератодермий [4].
Как наследственные, так и приобретенные кератодермии характеризуются хроническим прогредиентным течением, торпидным к терапии. У даннных пациентов имеются определенные затруднения при выборе профессии, устройстве на работу, а также сложности бытового характера. Больные кератодермиями, подавляющее большинство из которых женщины, испытывают выраженные психоэмоциональные расстройства, проблемы в личной жизни, у них значительно снижается самооценка. Все это приводит к ухудшению качества жизни и социального статуса, оказывает негативное влияние на материальное благосостояние, а в особо тяжелых случаях следствием заболевания может стать инвалидность [7, 12–15].
Терапевтические мероприятия при кератодермиях часто носят симптоматический характер. Для лечения всех форм кератодермий показано назначение ретиноидов, которые регулируют процессы роста и трансформации клеток, оказывают терапевтический эффект путем модуляции дифференцировки кератиноцитов, подавления гиперпролиферации и уменьшения инфильтрации воспалительными клетками. Для этого используются синтетические ретиноиды, фитоэстрогены [16–18].
Клинический эффект наблюдается не сразу, а по истечении 5–6 месяцев после начала приема препаратов и прекращается после их отмены. Однако они вызывают ряд побочных эффектов и имеют достаточно много противопоказаний. Наружное лечение кератодермий включает бальнеолечение, использование кератолитических и увлажняющих топических средств. Для наружной терапии также используют мази, содержащие витамины А, Е, регенерирующие препараты, а в ряде случаев – мази с глюкокортикоидами. Лечение назначают с учетом формы кератодермии и индивидуальных особенностей пациента. Важна профилактическая направленность, в частности применение топических антибактериальных и антимикотических средств [1].
Таким образом, в настоящее время ладонно-подошвенные кератодермии представлены гетерогенной группой дерматозов, что и диктует необходимость дальнейшего диагностического поиска и дифференцированного подхода к терапевтическим мероприятиям.
Цель работы – оценка клинической эффективности, обоснование целесообразности применения и перспектив использования в комбинированной терапии ладонно-подошвенных кератодермий «Ретинола пальмитата», мазей «Радевит® Актив» и «Уродерм».
Практическая значимость заключается в разработке схем терапии кератодермий у взрослых пациентов.
Под наблюдением находились 80 амбулаторных пациентов с диагнозом «диффузная ладонно-подошвенная кератодермия» (фото 1, 2). Диагноз устанавливался клинически и верифицировался обязательными лабораторными исследованиями, выполняемыми в соответствии с действующими рекомендациями.

Фото. 1. Ладонно-подошвенная кератодермия до лечения
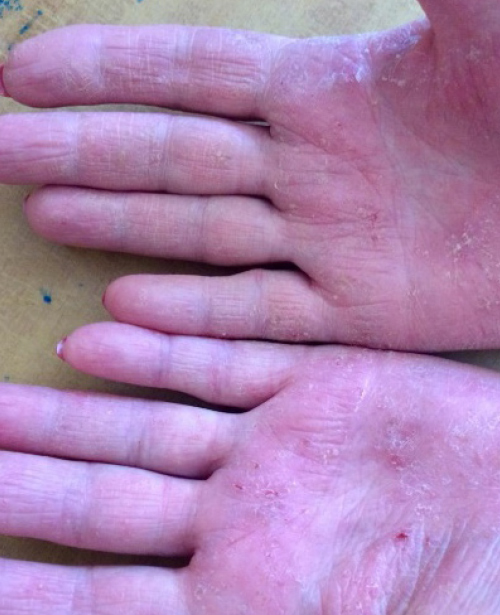
Фото. 2. Ладонно-подошвенная кератодермия до лечения
В план обследования входило определение показателей общего и биохимического анализа крови, общего анализа мочи. Контроль эффективности проводимой терапии осуществлялся путем сравнения показателей, полученных до начала лечения, через 30, 60 и 90 дней после начала терапии, и результат фиксировался в протоколе исследования пациента.
Основаниями включения пациентов в программу были:
Критериями исключения из групп были:
Все пациенты с учетом рандомизации были распределены по четырем группам. Средний возраст составил 45,5±7,4 года, добровольцы не имели признаков системности процесса, продолжительность заболевания варьировалась от 3 месяцев до 20 лет.
Группа 1 – контрольная. Пациенты получали стандартную терапию с наружным применением крема, обладающего увлажняющим, противовоспалительным и регенерирующим эффектом. Общий курс лечения составил 3 месяца.
Группа 2 – исследуемая. Пациенты принимали «Ретинола пальмитат» в дозе 100 000 МЕ в сутки (30 капель) в течение первых 2 месяцев. Затем 65 000 МЕ (20 капель) еще 1 месяц. В качестве наружной терапии утром была рекомендована мазь «Уродерм» под пленку на 30 минут, вечером – мазь «Радевит® Актив». Общий курс лечения составил 3 месяца.
Группа 3 – исследуемая. Пациенты принимали «Ретинола пальмитат» в дозе 200 000 МЕ в сутки (60 капель) в течение 2 месяцев. Затем 130 000 МЕ (40 капель) еще 1 месяц. В качестве наружной терапии утром наносили мазь «Уродерм» под пленку на 30 минут, вечером – мазь «Радевит® Актив». Общий курс лечения составил 3 месяца.
Группа 4 – исследуемая. Пациенты принимали «Ретинола пальмитат» в дозе 300 000 МЕ в сутки (90 капель) в течение 2 месяцев. Затем 200 000 МЕ (60 капель) еще 1 месяц. В качестве наружной терапии утром применяли мазь «Уродерм» под пленку на 30 минут, вечером – мазь «Радевит® Актив». Общий курс лечения составил 3 месяца.
Для реализации цели исследования использовались следующие стандартные критерии оценки эффективности терапии:
Влияние комбинированной терапии на выраженность основных клинических признаков оценивали по нескольким критериям:
– динамика степени выраженности зуда, рассчитываемая по 10-балльной шкале Visual Analogue Scale (VAS);
– динамика регресса площадей зон поражения (в процентном эквиваленте) – относительное изменение размера участков пораженной кожи, наблюдаемое в процессе лечения, в сравнении с исходным уровнем;
– динамика регресса объективных симптомов заболевания, оцениваемая по результатам изменения в каждой контрольной точке наблюдения показателя дерматологического индекса шкалы симптомов (ДИШС).
Все показатели оценивались на 1, 30, 60 и 90-е сутки наблюдения.
Оценка результатов в группах по числу пациентов, достигших клинического выздоровления (отличный результат лечения – уменьшение выраженности клиники на 75% и выше в сравнении с исходным уровнем), значительного улучшения (хороший результат лечения – уменьшение выраженности на 50–75% от исходного уровня), умеренного улучшения (удовлетворительный результат лечения – уменьшение на 25–50% в сравнении с клинической картиной при поступлении), отсутствия эффекта (неудовлетворительный результат лечения – уменьшение выраженности клинического признака менее 25% от исходного уровня). Представление результатов – балльная оценка степени выраженности изучаемых явлений до обращения и после лечения. Для достоверности полученных результатов при статистической обработке данных использовали метод ранжирования: отличному результату соответствовали 3 балла, хорошему – 2 балла, удовлетворительному – 1 балл, неудовлетворительному – 0 баллов.
Сравнительная оценка безопасности и переносимости комбинированной терапии определялась по субъективным (анкетные данные) и объективным (клинические наблюдения) параметрам.
Длительность терапевтического эффекта и характер межрецидивного периода оценивали по отсутствию субъективных признаков (0 баллов) или их наличию (1 балл). Продолжительность межрецидивного периода определяли в неделях.
Степень выраженности рецидивов ранжировали в баллах по сравнению с клинической картиной при первом обращении. Выраженная – соответствующая и превосходящая предыдущий клинический эпизод (75% и более) – 3 балла; умеренная (от 25% до 75%) – 2 балла; незначительная (менее 25% от клинической картины при первом обращении) – 1 балл.
Изменения в оценке качества жизни определялись на основании динамики Dermatology Life Quality Index. Оценка психосоматического статуса до и после лечения осуществлялась для анализа силы влияния комбинированной терапии на уровень и качество физического, психологического, социального и ролевого или функционально-ассоциированного образа жизни пациентов с помощью анкетирования. Пациент самостоятельно заполнял универсальную форму стандартного опросника, представляющего собой русифицированную версию Dermatology Life Quality Index, или дерматологический индекс качества жизни (ДИКЖ). Контрольные временные параметры фиксировались при поступлении, на 30, 60 и 90-е сутки наблюдения или при возникновении рецидивов.
Анализ итогов и качества лечения, потребительских свойств, исследование реакции и отношения пациентов к использованию нового для них средства наружной терапии проводились путем анкетирования. Методика представляла собой самостоятельное заполнение пациентами опросника, позволяющего оценить их комплаентность и дальнейшие перспективы применения препарата больными с ладонно-подошвенными кератодермиями.
Статистическая обработка проводилась с применением общепринятых методов параметрической и непараметрической статистики (программы Excel и Statistica 6.0). Для сравнения качественных, количественных и полуколичественных признаков использовали критерии χ2 и Вилкоксона–Манна–Уитни. Данные представлялись в виде абсолютных или относительных (%) величин, количественные – в виде M±SE, где M – среднее арифметическое, SE – ошибка средней величины. Разница значений считалась значимой при p<0,05 (95% ДИ – доверительный интервал).
При обращении за медицинской помощью все пациенты были распределены по группам исследования с обязательной оценкой клинических проявлений заболевания (табл. 1).
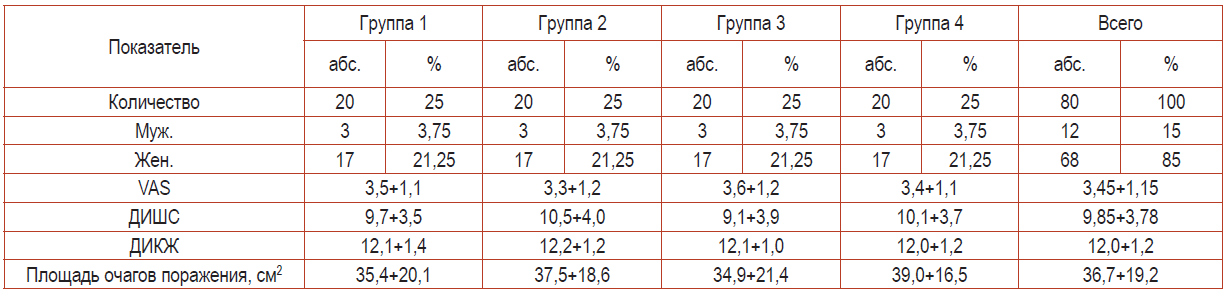
Таблица 1. Характеристика пациентов при обращении
Значимых различий в степени выраженности оцениваемых клинических проявлений заболевания, а также существенных расхождений в оценке качества жизни пациентов всех групп отмечено не было: исходные показатели в группах сравнения были статистически неразличимы (p>0,05).
Анализ влияния комбинированной терапии на выраженность основных клинических признаков мы проводили на 1, 30, 60 и 90-е сутки исследования (табл. 2).
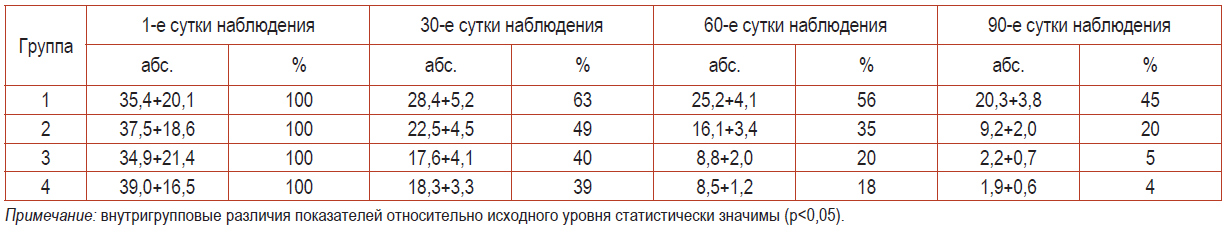
Таблица 2. Динамические характеристики площади очагов поражения кожного покрова на фоне терапии
Во всех группах исследования отмечалась общая тенденция регресса очагов поражения. В первой группе выраженность клинических проявлений за все время наблюдения уменьшилась более чем в 2 раза.
Во второй группе подобное нивелирование фиксировалось уже на 30-й день от начала лечения, а к 90-му дню наблюдения результаты были практически в два раза лучше, чем в 1-й группе. Максимальные показатели были достигнуты в 3-й 4-й группах. Статистически достоверных различий в них выявлено не было. К 30 дню лечения очаги поражения кожного покрова сократились более чем в 2 раза, а к окончанию терапии уменьшились до единичных процентов.
Динамические изменения субъективных и объективных параметров патологического процесса представлены на графиках 1 и 2.
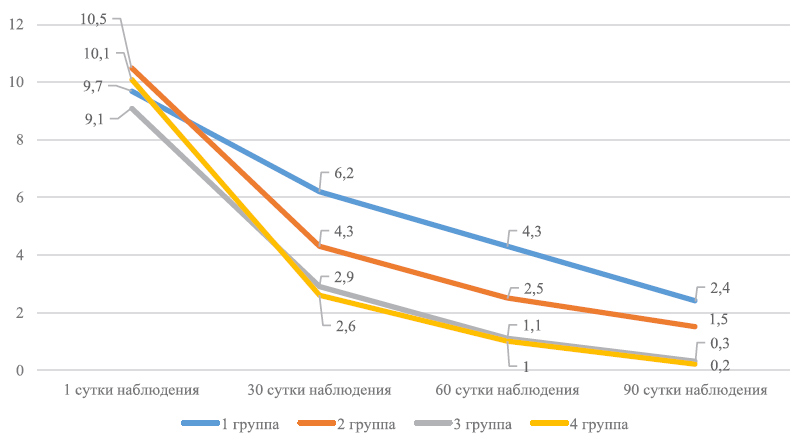
График 1. Динамика ДИШС на фоне лечения
Примечание: внутригрупповые различия показателей относительно исходного уровня статистически значимы (p<0,05).
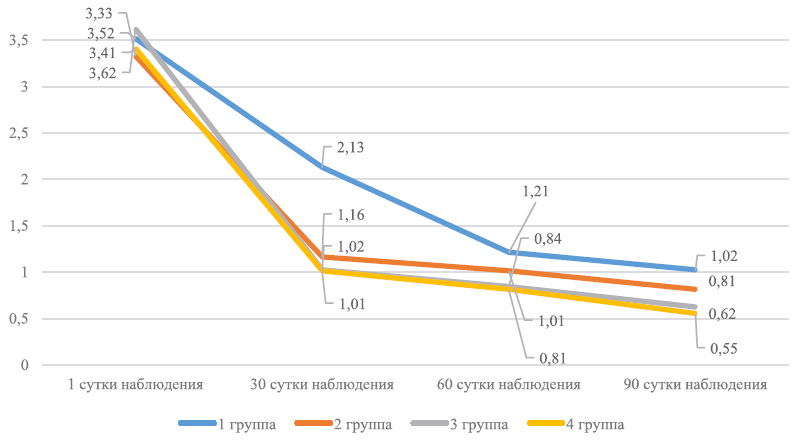
График 2. Динамика VAS на фоне лечения
Примечание: внутригрупповые различия показателей относительно исходного уровня статистически значимы (p<0,05).
В процессе лечения средние величины ДИШС и VAS во всех группах исследования статистически значимо сократились (p<0,05). Детальный анализ данных в представленных графиках, иллюстрирующий динамику уменьшения основных симптомов патологического процесса, позволяет заметить отчетливые различия скорости их купирования в группах сравнения. Выраженность воспалительного процесса (гиперемия, отек), шелушение и сухость кожи к концу лечения уменьшились в 1-й группе более чем в 4 раза, во 2-й группе – примерно в 10 раз, а в 3-й и 4-й – практически нивелировались.
Как клинически значимый, хотя и статистически недостоверный, признак более высокой эффективности использования изучаемого препарата у пациентов с ладонно-подошвеннными кератодермиями можно рассматривать факт полного отсутствия зуда у значительной части больных 2–4-й групп к моменту завершения лечения (фото 3, 4). В то же время ни у одного из пациентов 1-й группы полного исчезновения данного симптома добиться так и не удалось.
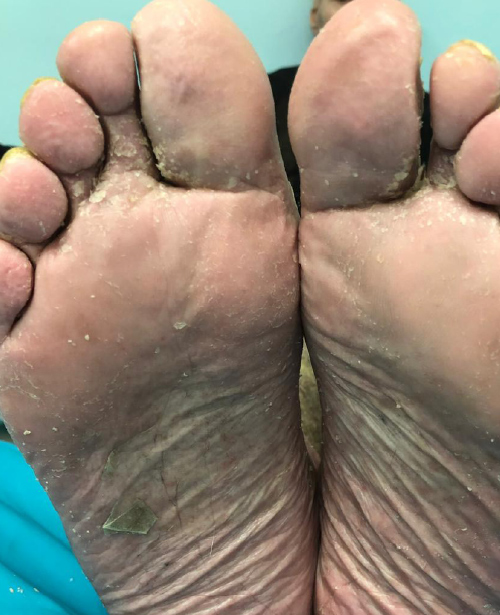
Фото. 3. Ладонно-подошвенная кератодермия после лечения
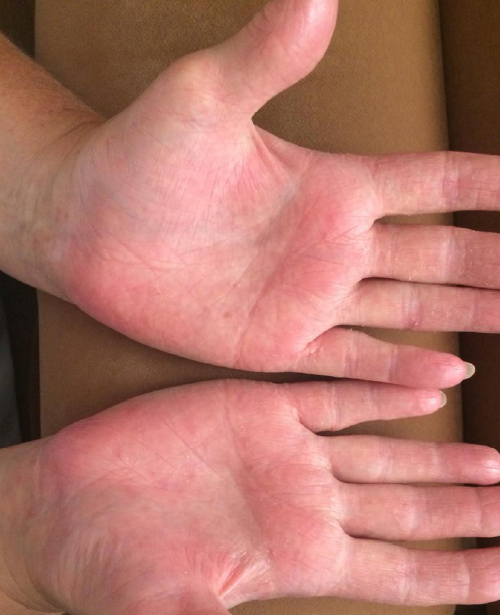
Фото. 4. Ладонно-подошвенная кератодермия после лечения
Результаты анализа терапевтической эффективности традиционной и комбинированной терапии представлены в табл. 3.
Сравнительный анализ данных, приведенных в табл. 3, демонстрирует различия результатов лечения у пациентов всех групп. Если в 1-й группе средний балл лечения может быть определен как неудовлетворительный, то во 2-й группе – как удовлетворительный. Хорошие результаты показала комбинированная терапия в 3-й и 4-й группах исследования. Причем в 3-й группе она была наиболее эффективной, поскольку не имела нежелательных проявлений в виде аллергических реакций.
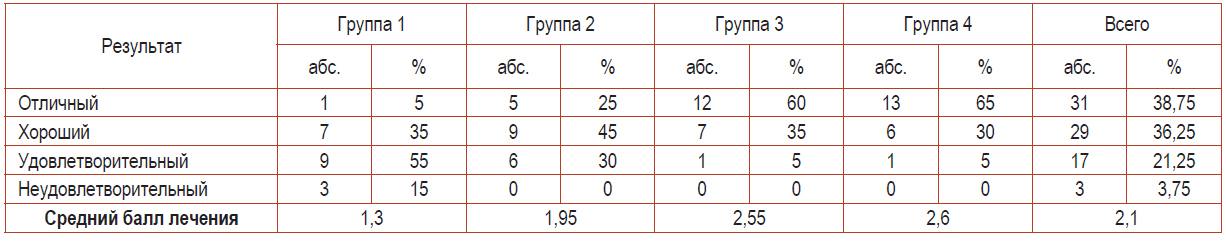
Таблица 3. Совокупный терапевтический эффект лечения пациентов с ладонно-подошвенными кератодермиями
Сравнительная оценка безопасности и переносимости комбинированной терапии определялась по субъективным (анкетные данные) и объективным (клинические наблюдения) параметрам (табл. 4).
На фоне лечения зафиксированы положительные эффекты в группах комбинированной терапии. Однако следует отметить более слабую стабилизацию тонуса сосудов микроциркуляторного русла у пациентов четвертой группы в сравнении с третьей. Телеангиэктазии незначительно утратили яркость клинических проявлений, в четвертой группе имели место два случая аллергических проявлений, выражающихся в появлении легкой эритемы и зуда.
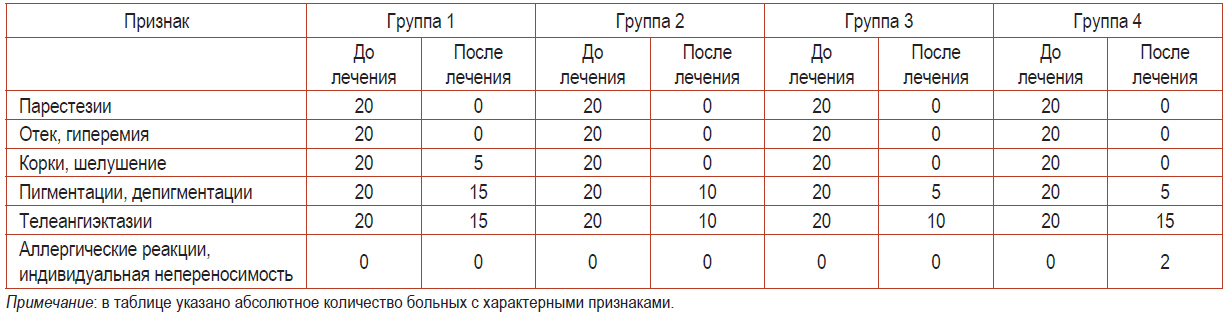
Таблица 4. Клиническая картина у пациентов исследуемых групп на фоне проводимой терапии
Аллергическая реакция отмечалась в конце второго месяца лечения, была купирована применением антигистаминных препаратов в течение 5 дней в стандартной дозировке. В ходе поддерживающей терапии аллергических реакций в группах не наблюдалось.
Длительность терапевтического эффекта и характер межрецидивного периода представлены на графике 3.
Положительный эффект терапии сохранялся в первой группе около двух недель, во второй – 1 месяц. В третьей и четвертой группах межрецидивный период достигал двух месяцев полного клинического благополучия.
Рецидивы патологического процесса в группах исследования также имели свои особенности (табл. 5).

Таблица 5. Выраженность рецидивов у пациентов исследуемых групп
При анализе выраженности рецидивов в группах исследования были установлены следующие результаты: в 1-й и 2-й группах рецидив был определен как выраженный, в 3-й и 4-й – как умеренный.
Нами был проведен анализ силы влияния комбинированной терапии на уровень и качество физического, психологического, социального и ролевого или функционально-ассоциированного образа жизни пациентов. Контрольные точки – при поступлении, на 90-е сутки наблюдения и при возникновении рецидивов (табл. 6).
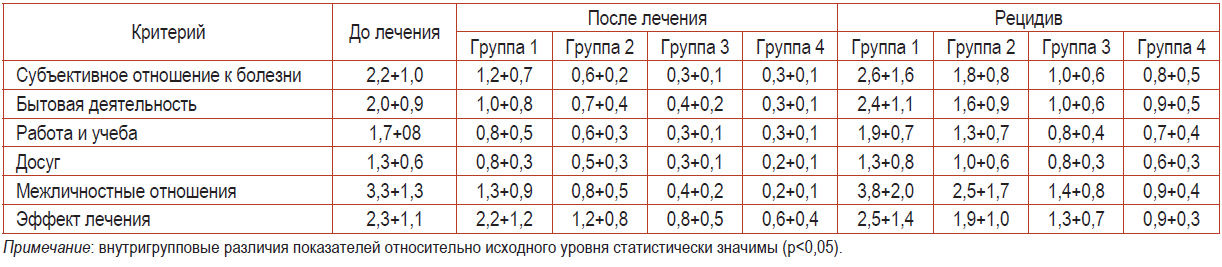
Таблица 6. Анализ влияния терапии на качество жизни
Детальный анализ, проведенный по основным разделам, показал наличие клинически значимых различий в оценке качества жизни абсолютного большинства пациентов во всех группах до и после лечения. В 1-й группе исследования отмечали некоторое улучшение качества жизни на фоне лечения, однако рецидив не только вернул, но даже несколько усилил некоторые показатели.
Пациенты 2-й группы отнеслись к результатам лечения более оптимистично, и в последующем рецидиве и показатели качества жизни были выше, чем при первичном обращении. Наилучшие показатели ДИКЖ после терапии и во время рецидива были отмечены у обследуемых 3-й и 4-й групп, причем статистически достоверно они не различались.
При сравнительном анализе потребительских свойств препаратов, рекомендованных для традиционного и комбинированного лечения, нами были получены следующие результаты (табл. 7).
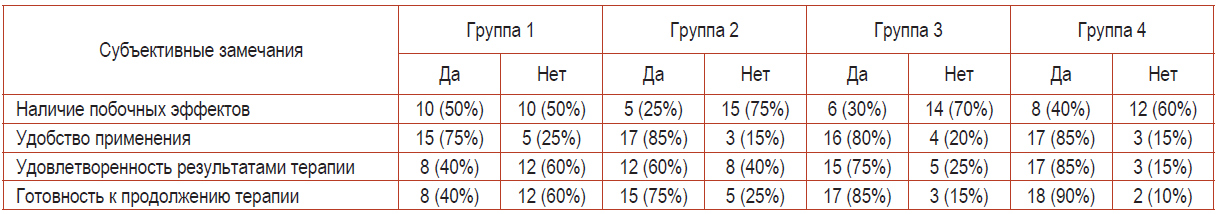
Таблица 7. Оценка потребительских качеств лекарственной терапии
Участники второй группы исследования в сравнении с пациентами первой группы реже предъявляли жалобы на наличие побочных эффектов, отмечали удобство применения препаратов, большую удовлетворенность лечением и готовность к продолжению терапии. На наш взгляд, данная позиция обусловлена относительно быстрыми и продолжительными клиническими эффектами терапевтического воздействия у пациентов второй группы исследования в сравнении с первой.
Существенных различий в показателях третьей и четвертой групп выявлено не было, при этом хотелось бы отметить, что пациенты этих групп были настроены более опти- мистично по сравнению с добровольцами второй группы.
Комбинированная терапия оказала позитивное воздействие на степень выраженности основных клинических проявлений заболевания, продолжительность ремиссии и характер рецидива.
Использование рекомендуемых схем лечения не вызывает изменения биохимических показателей крови, однако в двух случаях при назначении очень высоких доз «Ретинола пальмитата» были зафиксированы легкие аллергические реакции, купировавшиеся при помощи антигистаминных препаратов.
Соответственно, лечение обладает высокими показателями безопасности и переносимости и характеризуется выраженным положительным влиянием на качество жизни пациентов.
Таким образом, комбинированная терапия, включающая применение «Ретинола пальмитата», дополненная использованием мазей «Уродерм» и «Радевит® Актив», признана клинически эффективной. В случае пациентов с ладонно-подошвенными кератодермиями она обладает высокими потребительскими характеристиками и может быть рекомендована к практическому применению по схеме, используемой в третьей группе исследования. Общий курс лечения – 3 месяца, с назначением «Ретинола пальмитата» в дозе 200 000 МЕ в сутки (60 капель) в течение 2 месяцев, затем 130 000 МЕ (40 капель) еще 1 месяц. В качестве наружной терапии применять утром мазь «Уродерм» под пленку на 30 минут, вечером мазь – «Радевит® Актив» в течение 2 недель. Затем мазь «Радевит® Актив» наносить утром и вечером в течение еще 2 недель.
Не забудьте вступить в наши группы в социальных сетях!