А.Н. Яцковский, Т.А. Белоусова, С.А. Жучков, В.И. Ноздрин – ЗАО «Ретиноиды», Москва, Россия;
Синтетическое пиримидиновое производное метилурацил (МУ) активизирует внутриклеточные биосинтетические процессы, в особенности синтез нуклеиновых кислот и белков [4, 7, 10, 11], стимулирует пролиферацию в клеточных популяциях [12], влияет на систему гуморального иммунитета [14], вызывает изменения клеточного состава периферической крови [9] и оказывает ряд других воздействий на организм. Лекарственные формы с МУ для перорального и наружного употребления нашли широкое применение в различных областях клинической медицины, в частности, в дерматологии и хирургии. Так, МУ хорошо зарекомендовал себя как средство, способствующее восстановлению целостности кожи при ожогах [8, 13], в том числе лучевых [5], язвах, включая лепрозные [2, 3] и лейшманиозные [15], операционных ранах [1]. Однако несмотря на актуальность обсуждаемого вопроса, экспериментальные морфологические исследования дерматотропных, в том числе ранозаживляющих, свойств МУ немногочисленны [6].
Учитывая, что предлагаемая мазь с МУ 3 % на водоэмульсионной основе (Стизамет®) предназначена прежде всего для стимуляции заживления повреждений кожи, изучение её специфической дерматотропной фармакологической активности выполняли на модели кожных ожоговых ран.
Материал и методы
Исследование проводили на крысах-самках Вистар со средней массой 189,4±3,3 г. Термические ожоги вызывали путём наложения на 30 сек на кожу межлопаточной области спины, лишённой волосяного покрова, нагретого в течение 1 мин в кипящей воде (100 °С) медного куба массой 50 г с площадью соприкосновения 4 см2. Все манипуляции проводили под гексеналовым наркозом (80 мг/кг, в/б). Через сутки на месте ожогов возникали раны в виде изъязвлений, заполненных некротическими массами. К концу 1-й недели у всех животных на поверхности ран формировался первичный струп, который удаляли на 9-е сутки эксперимента.
Начиная со второго дня эксперимента и до момента заживления ран, на раневую поверхность ежедневно наносили 0,5 г мази с МУ ( 3 %) на водоэмульсионной основе (ВЭО); ежедневная разовая доза МУ при этом составляла около 80 мг/кг. Препаратом сравнения служила метилурациловая мазь 10 % на ланолин-вазелиновой основе (ЛВО), наносившаяся на раневую поверхность в том же количестве. В качестве контроля использовали крыс с ожоговыми ранами, не получавших мазь (без воздействия), и животных, которым на раны наносили мазевую ВЭО. Каждая из экспериментальных и контрольных групп включала по 12 животных.
В ходе эксперимента с интервалом 3–6 дней измеряли площадь раневой поверхности путём зарисовки краёв раны на приложенном к ней стерильном предметном стекле и последующей морфометрии с использованием полуавтоматической системы анализа изображений МОР-Videoplan (фирма Reichert).
Характер течения репаративного процесса оценивали визуально в дни измерений площади ран, а также по результатам гистологического исследования кожи, иссечённой из краёв раны в конце 3-й недели и по окончании эксперимента. На аппаратно-программном комплексе «ДиаМорф» (Россия) оценивали толщину росткового слоя эпидермиса в краях эпителизации ран по результатам не менее чем 150 измерений для каждой группы животных. В направлении от края эпителизации к центру раны в 3 полях зрения при увеличении 40 х 1,1 подсчитывали клеточную плотность дермы (суммарное число клеточных элементов в поле зрения), а также соотношение клеток воспалительного инфильтрата (полиморфноядерных, мононуклеарных) и фибробластов. О принадлежности клеток к соответствующим популяциям судили путём определения фактора формы, значения которого, по результатам предварительно проведённого исследования, варьируют для клеток фибробластического ряда в пределах 0,10–0,60, а для моноцитов, макрофагов, лимфоцитов, нейтрофилов – 0,61–1,0.
Статистическую обработку результатов всех исследований проводили с использованием t-критерия Стьюдента. Различия средних считали значимыми с уровнем вероятности не менее 95 % (в таблицах отмечены звездочками: * – 95 %, ** – 99 %, *** – 99,9 %).
Результаты исследования
При аппликациях мазей с МУ уже в начале 2-й недели после нанесения ожоговых ран имела место более выраженная, в сравнении с контрольной группой животных без воздействия, тенденция к уменьшению площади раневой поверхности. В группе животных, получавших мазь с МУ 3% на ВЭО, эти различия приобретали статистически значимый характер в течение первой недели наблюдения, а в группе препарата сравнения – к 12-му дню эксперимента (табл. 1).
Таблица 1. Динамика изменений площади ожоговых ран (в см2) при использовании мазей с МУ (n=12)
| Экспериментальные группы |
Дни наблюдений после начала аппликации мазей |
| до аппликац |
3-й |
12-й |
18-й |
28-й |
| без воздействия |
5,78±0,23 |
5,45±0,30 |
2,52±0,25 |
1,32±0,07 |
0,85±0,12 |
| ВЭО |
6,01±0,20 |
5,48±0,19 |
2,07±0,20 |
1,18±0,08 |
1,00±0,21 |
| мазь с МУ 10% на ЛВО |
6,07±0,25 |
5,00±0,27 |
1,75±0,12* |
0,91±0,5* |
0,80±0,32 |
| мазь с МУ 3% на ВЭО |
6,46±0,26 |
4,79±0,24* |
1,52±0,11** |
0,66±0,05*** |
0,27±0,10** |
Определение доли раневой поверхности по отношению к исходной площади раны позволило сопоставить скорости течения раневого процесса в экспериментальных группах животных. Установлено, что метилурациловая мазь 10 % на ЛВО обладает достаточно выраженным действием на этот показатель. Однако наибольшее влияние на скорость заживления ожоговых ран оказывает мазь с МУ 3 % на ВЭО (Стизамет®). На 28-е сутки эксперимента доля раневой поверхности для данной группы составила 4,2 % от исходной площади ран против 13 % – при аппликации препарата сравнения, 14,7 % – у животных без воздействия и 16,6 % – у животных, получавших мазевую основу, которая сама по себе практически не влияет на скорость репаративного процесса.
В прямой зависимости от скорости течения раневого процесса находятся сроки полного заживления ожоговых ран. В целом, на соответствующих этапах наблюдения процент животных с полной эпителизацией раневой поверхности был выше при использовании обеих мазей с МУ (табл. 2).
Таблица 2. Сроки заживления ожоговых ран при использовании мазей с МУ доля животных (в %) с полной эпителизацией раны по отношению к числу животных в группе, n=8
| Экспериментальные группы |
Дни наблюдений после начала аппликации мазей |
| 29-й |
33-ий |
36-ий |
40-ий |
44-ий |
| без воздействия |
– |
– |
– |
25,0 |
37,5 |
| ВЭО |
– |
– |
12,5 |
37,5 |
50,0 |
| мазь с МУ 10% на ЛВО |
12,5 |
25,0 |
50,0 |
62,5 |
62,5 |
| мазь с МУ 3% на ВЭО |
12,5 |
37,5 |
62,5 |
75,0 |
100 |
Ранее всего полная эпителизация раневой поверхности наблюдалась у отдельных животных при аппликации метилурациловой мази 10 % на ЛВО и мази с МУ 3 % на ВЭО (Стизамет®). Однако в последнем случае полное заживление ран у всех животных зарегистрировано значительно раньше, чем в остальных экспериментальных группах и у контрольных животных (рис. 1).
Одной из причин более быстрого заживления ожоговых ран при использовании мазей с МУ, вероятно, является его стимулирующее влияние на клеточную пролиферацию в эпителии кожи, на что косвенно указывают
результаты измерения толщины росткового слоя эпидермиса. Так, через 3 недели после начала эксперимента у животных без воздействия и при аппликации мазевой основы этот показатель составил соответственно
25,8±0,8 мкм и 24,2±0,8 мкм. Толщина росткового слоя эпидермиса после использования мази Стизамет® в этот же период наблюдения составила 35,6±1,0 мкм, а при аппликации метилурациловой мази 10 % на ЛВО –
42,3±1,3 мкм. Вероятность различий с показателями в контрольных группах животных составила 99,9 %. Полученные данные свидетельствуют также о дозозависимом влиянии МУ на пролиферацию клеток эпидермиса
в участках повреждения кожи. Характер течения раневого процесса варьировал в различных экспериментальных группах. Визуально нагноение ран в конце 1-й недели наблюдения отмечено у 25 % животных в группе без
воздействия, у 16,7 % крыс при аппликации ВЭО и у 8,3 % животных при аппликации метилурациловой мази 10 % на ЛВО. Признаки нагноения ран при аппликации мази с МУ, приготовленной на ВЭО, в эти сроки визуально не наблюдались.
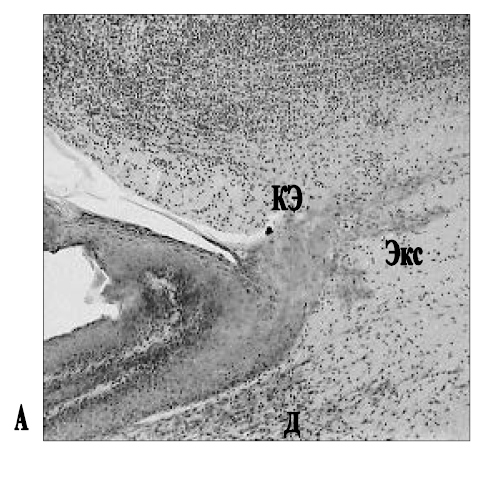
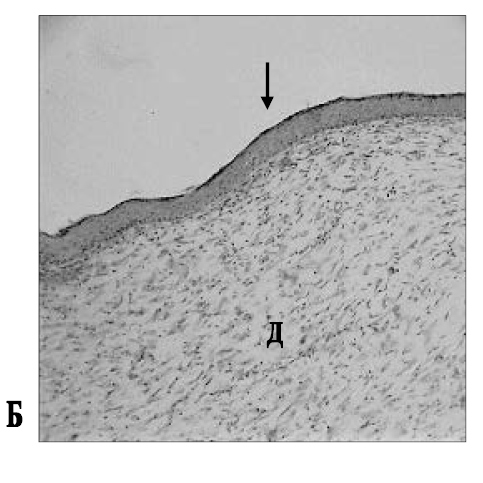
Рис. 1. Область ожоговой раны кожи у контрольного (без аппликаций) животного (А) и у крысы, получавшей аппликации мази Стизамет® (Б) на 46-й день эксперимента: А – край эпителизации (КЭ), в дерме (Д) присутствует серозно-гнойный экссудат (Экс); Б – полная эпителизация раневой поверхности (стрелка), дерма (Д) образована волокнистой соединительной тканью. Об.: 10.
Результаты макроскопического наблюдения нашли подтверждение при гистологическом исследовании образцов кожи, иссечённых из краёв ран в конце 3-й недели эксперимента. Во всех случаях в зоне раны отмечены признаки воспаления: гиперемия сосудов дермы под раневой поверхностью и её клеточная инфильтрация, выраженные, однако, неодинаково в различных группах. У контрольных животных часто наблюдался диапедез
эритроцитов. В обеих контрольных группах и у животных, получавших метилурациловую мазь 10 % на ЛВО, отмечалось большое количество серозно-гнойного экссудата, содержащего преимущественно нейтрофильные
лейкоциты и локализованного под поверхностными некротическими массами и вблизи края эпителизации. При использовании 3 % мази с МУ на ВЭО полнокровие сосудов было менее выражено, гнойный экссудат отсутствовал (рис. 2).
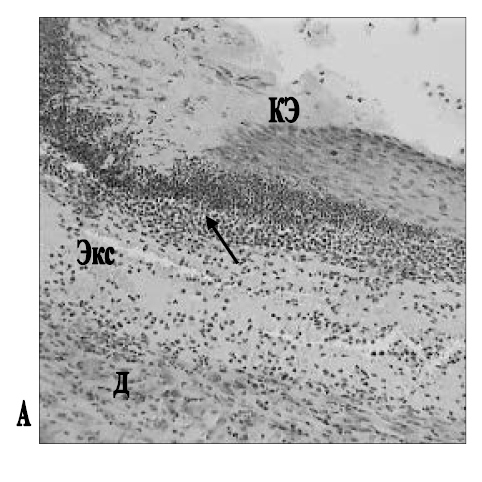
Рис. 2. Ожоговые раны кожи у крыс через 20 дней аппликаций мази с МУ 10 % на ЛВО (А) и мази Стизамет® (Б): А – под утолщенным краем эпителизации (КЭ) в дерме (Д) присутствуют скопления разрушенных полиморфноядерных лейкоцитов (стрелка) и серозный экссудат (Экс); Б – край эпителизации над грануляционной тканью дермы (Д), умеренно инфильтрированной лейкоцитами. Об.: 20.
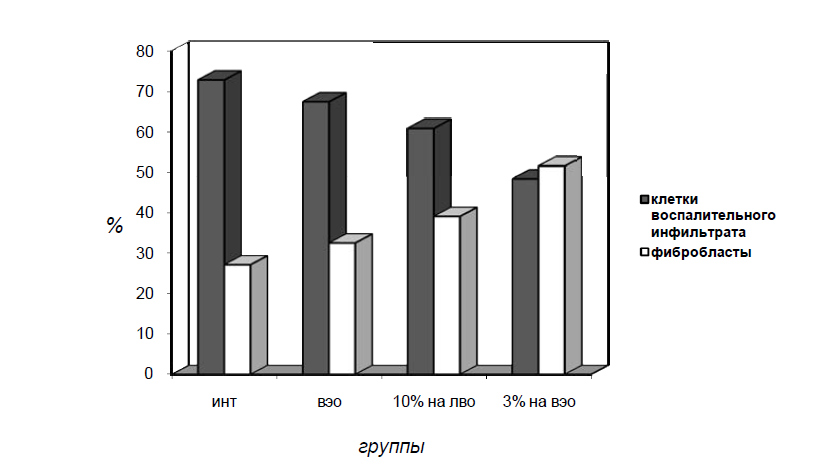
Результаты анализа клеточного состава дермы под раневой поверхностью через 3 недели после нанесения ран (табл. 3) коррелируют с указанными выше особенностями течения раневого процесса при использовании
разных мазей с МУ. Так, в сравнении с животными контрольных групп, суммарное число клеточных элементов в дерме, подсчитанное на поле зрения микроскопа, значимо снижается при аппликациях мази Стизамет®. При
этом наблюдается отчётливо выраженный сдвиг в сторону клеток фибробластического ряда, что в совокупности свидетельствует о более быстром разрешении в этих условиях воспалительного процесса, развивающегося в
месте ожога (рис. 3).
Таблица 3. Клеточная плотность (M±m) и соотношение различных типов клеток (в %) в единице площади дермы через 3 недели после нанесения ожоговой раны и использования мазей с
МУ (n=6)
| Экспериментальные группы |
Клеточная плотность |
Доля клеток |
| воспалительного инфильтрата |
фибробластического ряда |
| без воздействия |
78,9±3,3 |
72,9 % |
27,1 % |
| ВЭО |
87,3±6,3 |
67,5 % |
32,5 % |
| мазь с МУ 10% на ЛВО |
83,3±5,7 |
60,9 % |
39,1 % |
| мазь с МУ 3% на ВЭО |
47,4+3,5* |
48,4 % |
51,6 % |
Примечание: * – вероятность различий с группой животных без воздействия составляет 95 %.
Таким образом, в качестве возможных причин ранозаживляющего эффекта препарата Стизамет®, наряду со стимуляцией пролиферативных процессов в эпидермисе, являются модификация воспалительного процесса
в сторону активации фибробластической реакции дермы, а, возможно, и модулирующее влияние МУ на иммунокомпетентные клетки кожи.
Рис. 3. Соотношение различных типов клеток (в %) в единице площади дермы через 3 недели после нанесения ожоговой раны и использования мазей с МУ.
Заключение
Мази, содержащие метилурацил, оказывают стимулирующее влияние на процессы репаративной регенерации кожи, независимо от состава использованной для их приготовления основы.
Мазь метилурациловая 3 % на водоэмульсионной основе (препарат Стизамет®) стимулирует пролиферацию эпителия кожи в зоне повреждения. В сравнении с 10 % мазью с МУ на ЛВО, она отчётливо подавляет
воспалительную и активирует фибробластическую реакцию дермы, что определяет её более выраженное стимулирующее влияние на заживление ожоговых ран.
Литература
- Билич Г.Л., Колла В.Э., Эйдельштейн С.И., Галецкий Г.И. Плёнкообразующие аэрозоли и их применение в медицине – Йошкар-Ола: Марийское книжное издательство, 1977. – С. 131.
- Вальтер В.Г., Батчаева Л.Х. К вопросу о лечении трофических язв и вялогранулирующих ран метилурацилом // Применение пиримидиновых и пуриновых производных в онкологии и других областях медицины: Матер. конф. – Л., 1966. – С. 24.
- Вальтер В.Г., Голощапов Н.П. Хирургические методы лечения трофических язв подошв в комплексе с пиримидинами у больных лепрой // Применение пиримидиновых и пуриновых производных в хирургии и смежных областях медицины: Матер. конф. – Ростов н/Д.: Мин. здравоохр. СССР, Рост. гос. мед. инст., 1970. – С. 258–261.
- Волощенко О.И. Влияние метилурацила на интенсивность анаболических процессов у интактных крыс // Регуляция воспаления и регенерации в хирургии: Матер. Всесоюз. симп. – Ростов н/Д., 1976. – С. 87–89.
- Гершанович М.Л. Лечебное действие метацила (4-метилурацила) при повреждениях слизистых оболочек у больных, подвергающихся лучевой терапии по поводу злокачественных опухолей // Применение пиримидиновых производных в онкологии и других областях медицины: Матер. конф. – Л., 1963. – С. 17–20.
- Журавлёва М.В., Музыкант Л.И., Каем Р.И. Влияние метилурацила на воспалительную реакцию и регенеративные процессы в ожоговой ране при экспериментальных термических ожогах // Регуляция воспаления и регенерации в хирургии: – Матер. Всесоюз. Симп. – Ростов н/Д., 1976. – С. 143–145.
- Касаткин В.Ф., Ефремова О.А., Глущенко В.А. Влияние аппликации метилурацила в гипоталамус на динамику веса, характеристики послеоперационного рубца и уровень нуклеиновых кислот печени белых крыс // Фармакологическая регуляция регенераторных процессов. – Матер.конф. – Йошкар-Ола: Мин. высш. и средн. спец. обр. РСФСР, Марийский гос. универс., 1979. – С. 251–252.
- Кольцова Л.А., Широков В.Н., Шерпутовская К.Е., Амиров И.М. Применение метилурациловой мази в комплексном лечении ожогов лица // Фармакологическая регуляция регенераторных процессов. – Матер. конф. – Йошкар-Ола: Мин. высш. и средн. спец. обр. РСФСР, Марийский гос. универс., 1979. – С. 212.
- Лазарев Н.В. Лекции по фармакологии системы крови. – Л.: Медгиз, 1960. – 83 с.
- Лифшиц Р.И. Пиримидиновые производные как анаболизаторы // Применение пиримидиновых производных в онкологии и других областях медицины: Матер. конф. – Л., 1963. – С. 62–64.
- Перская Е.Л. Влияние метилурацила, вводимого в предоперационной подготовке, на скорость включения лизина-С14 в белки различных органов и тканей белых крыс в ближайший послеоперационный период после резекции желудка // Тез. секц. сообщ. 2-го Всесоюз. биох. съезда (секц. 15). – Ташкент: Фан, 1969. – С. 201–202.
- Попова О.И. Влияние 6-метилурацила на обмен свободных нуклеотидов в нормальной и регенерирующей печени крыс (экспериментальное исследование): Автореф. дис. канд. биол. наук. – М., 1980. – 22 с.
- Тупаков Н.П. Применение метилурацила для лечения ожогов // Применение пиримидиновых и пуриновых производных в гастроэнтерологии: Матер. конф. – Барнаул, 1967. – С. 130–131.
- Хасанова Д.Д. Первичный иммунный ответ при сочетанном применении метилурацила с левамизолом // Возрастные проблемы патологии: Тез. докл. 53-й научн. конф. мол. уч. БГМП. – Уфа, 1988. – С. 135.
- Hossain M.Z. Combination therapy (monomycine and methyluracil) in leishmaniasis cutis // Int. J. Dermatol. – 1988. – Vol. 27, №10. – P. 720–722.



Не забудьте вступить в наши группы в социальных сетях!