К.Н. ПУСТОВАЯ1, Г.А. ПЬЯВЧЕНКО1,2, М.В. АРИСОВ3, В.И. НОЗДРИН1
1 – АО «Фармацевтическое научно-производственное предприятие «Ретиноиды»», Балашиха, Московская область, Россия;
2 – ФГАОУ ВО «Первый Московский государственный медицинский университет им. И.М. Сеченова» (Сеченовский университет) Минздрава России, Москва, Россия;
3 – ВНИИП — филиал ФГБНУ ФНЦ ВИЭВ РАН, Москва, Россия;
Резюме
Цель исследования — изучить акарицидное действие препарата Д-18 (АО «Ретиноиды», Россия) на клещах рода Demodex в исследовании in vitro.
Материал и методы. Исследовали содержимое соскобов кожи сально-волосяных комплексов у 10 здоровых добровольцев, взятое с крыльев носа, на наличие клещей рода Demodex. Критерием отбора клещей в экспериментальные группы (по 5 от каждого добровольца, общее число паразитов в группе — 50 особей) стала их выраженная двигательная активность. Все паразиты принадлежали к виду Demodex folliculorum. Выделенных клещей на предметном стекле помещали в раствор глицерина и в зависимости от группы исследования вплотную окружали акарицидным препаратом, его мазевой основой или препаратом сравнения — ивермектином 1%. Под микроскопом каждые 30 мин от начала исследования оценивали двигательную активность клещей до момента гибели, которую констатировали по отсутствию признаков движения.
Выводы. Акарицидная мазь и препарат сравнения (ивермектин 1%) обладают в равной степени выраженным акарицидным эффектом в отношении клещей вида Demodex folliculorum в исследовании in vitro.
Ключевые слова: акарицидный препарат, клещи Demodex, исследование in vitro, демодекоз, ивермектин.
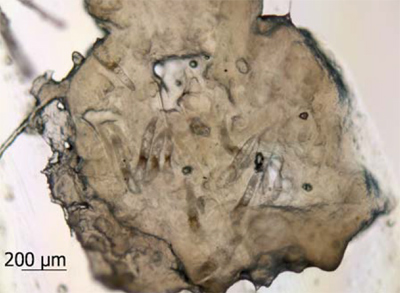
Рис. 1. Клещи рода Demodex в секрете сальной железы, полученные при соскобе
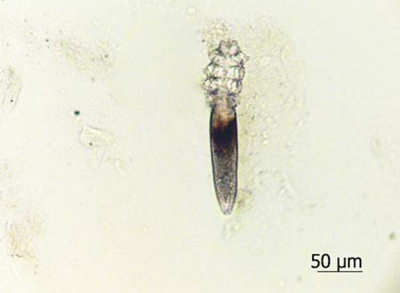
Рис. 2a. Микрофотографии клещей: в основе препарата
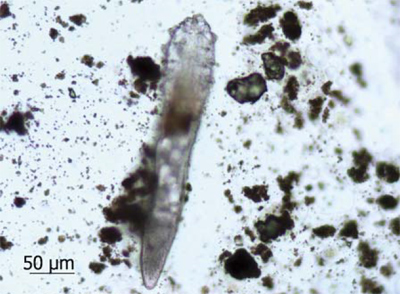
Рис. 2b. Микрофотографии клещей: в препарате Д-18
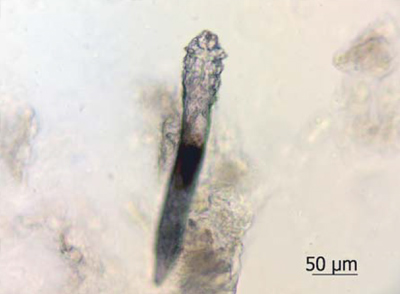
Рис. 2c. Микрофотографии клещей: в препарате сравнения, содержащем ивермектин 1%
В настоящее время на российском рынке отсутствуют акарицидные препараты отечественного производства, у которых в инструкции по медицинскому применению был бы отмечен противопаразитарный эффект в отношении клещей рода Demodex, что вызывает острую необходимость разработки такого лекарства. В доклиническом исследовании эффективности нового лекарственного препарата изучали его специфическую активность в отношении паразитирующих в коже человека клещей рода Demodex. В норме клещи обитают в устьях сальных желез и волосяных фолликулах, являются сапрофитами, однако вследствие нарушения местного иммунитета (предположительно) могут становиться паразитами. На рис. 1 изображены клещи в скоплении кожного сала.
Цель исследования — изучение акарицидного действия препарата Д-18 (АО «Ретиноиды», Россия) в отношении клещей рода Demodex в эксперименте in vitro. В задачи работы входили:
- изучение акарицидного действия препарата Д-18 (АО «Ретиноиды», Россия);
- сравнительный анализ действия нового средства с акарицидным действием и препарата, содержащего ивермектин 1%.
Материал и методы
Тестируемый препарат был предоставлен АО «Ретиноиды» в металлических тубах по 35 г. Тубы хранили в холодильнике (температурный интервал: +2—4 °C) в провизорской комнате с ограниченным доступом и контролируемыми условиями среды [1, 2]. По окончании исследования неиспользованные остатки препарата утилизировали. В работе участвовали 10 здоровых добровольцев в возрасте от 30 до 75 лет, у которых в утренние часы с помощью шпателя с крыльев носа выполняли забор содержимого сально-волосяных комплексов. Под микроскопом выделяли взрослых особей клещей и помещали в 50% водный раствор глицерина, после чего подтверждали их видовую принадлежность. Для эксперимента отбирали особей с выраженной двигательной активностью тела, конечностей и ротового аппарата. Взятие соскоба повторяли через 1 нед во всех экспериментальных группах. Выделенных клещей препаровальной иглой перемещали из капли раствора глицерина на левую половину стекла и в зависимости от группы исследования вплотную окружали препаратом Д-18, его мазевой основой или препаратом сравнения с 1% ивермектином (рис. 2). В каждой группе наблюдали за 5 клещами, полученными от одного добровольца. Таким образом, количество изучаемых паразитов в группе из 10 человек составило 50 особей.
Специфическую акарицидную активность мази в сравнении с препаратом со сходным действием изучали в соответствии с ранее опубликованной методикой [3]. Под микроскопом каждые 30 мин с момента окружения препаратами оценивали двигательную активность тела, конечностей и ротового аппарата клещей. Гибель констатировали по отсутствию признаков движения. Микроскопическое исследование проводили на световом микроскопе Axioskop 2 с камерой AxioCam и программным обеспечением AxioVision («Carl Zeiss», Германия).
Для оценки среднего времени гибели клещей рода Demodex применяли методы описательной статистики: подсчитывали среднее значение (M) и стандартную ошибку среднего (SE), которые представляли в итоговой таблице. Для определения достоверности межгрупповых различий данные проанализировали параметрическими или непараметрическими критериями в зависимости от типа распределения количественных данных. Анализ выполняли и усредняли для каждого добровольца отдельно, после чего усредняли для всех 10 человек, что позволило учесть ошибку с поправкой на индивидуальные особенности добровольцев. Таким образом, в знаменателе вычисляемой ошибки за число значений принимали 10 (число добровольцев), а не 50 (суммарное количество клещей в каждой группе, полученное от 10 человек). При определении нормальности распределения использовали критерий Колмогорова—Смирнова, согласно которому во всех случаях распределение величин было нормальным; это позволило применить для оценки достоверности различий между группами t-критерий Стьюдента. Расчеты проводили с использованием программного обеспечения Microsoft Excel. Различия определяли при уровне значимости в 5% [4, 5].
Результаты
Результаты исследования акарицидного действия препарата Д-18, его основы и препарата сравнения (ивермектин 1%) на клещах рода Demodex представлены в таблице.
Отмечено акарицидное действие препарата Д-18, сопоставимое по времени гибели клещей с результатами, полученными для препарата сравнения (ивермектин 1%); статистически значимые различия между этими экспериментальными группами не обнаружены.
Отсутствие различий между изучаемыми признаками мази Д-18 и препарата сравнения (ивермектин 1%) свидетельствует о равноценном выраженном акарицидном эффекте при применении препаратов.
Обсуждение
Клещи рода Demodex являются сапрофитами кожи человека, однако существуют причины, способствующие их переходу в патогенную форму. Так, воздействие высоких температур, ультрафиолетовое излучение, неблагоприятные бытовые и рабочие условия относят к внешним причинам; изменения в иммунной системе человека, связанные с заболеваниями нервной, сосудистой, гормональной систем, желудочно-кишечного тракта, нарушение функций обменных процессов — к внутренним [6]. Осложнение демодекозом является седьмым по частоте среди кожных заболеваний и составляет 2—5%, его частота у пациентов с розацеа — 88,7%, у лиц с папуло-пустулезными дерматозами — 10,5%, а с периоральным дерматитом — 58,8% [7—10]. По данным литературы [11, 12], демодекоз может быть как самостоятельным первичным процессом, так и сопровождать такие заболевания, как акнеформные дерматозы, фолликулиты, себорейный дерматит и т.д.
Среднее время гибели клещей рода Demodex в эксперименте, час
| Добровольцы |
Воздействие |
| интактные |
основа |
Д-18 |
ивермектин 1% |
| М., 75 лет |
7,3 |
6,9 |
2,6 |
1,6 |
| К., 52 года |
7,6 |
7,2 |
3,0 |
2,8 |
| С., 48 лет |
7,5 |
7,8 |
2,7 |
1,9 |
| Н., 44 года |
7,2 |
7,0 |
2,3 |
1,8 |
| Б., 41 год |
7,7 |
7,7 |
2,3 |
2,3 |
| Д., 37 лет |
7,1 |
7,5 |
2,4 |
1,8 |
| С., 37 лет |
7,6 |
7,6 |
2,0 |
1,9 |
| Н., 35 лет |
7,8 |
7,6 |
2,4 |
1,8 |
| К., 33 года |
7,9 |
7,7 |
2,3 |
2,6 |
| А., 30 лет |
7,6 |
7,0 |
2,4 |
2,6 |
| M±SE |
7,5±0,1 |
7,4±0,1 |
2,4*±0,1 |
2,1*±0,1 |
Примечание. * — p≤0,05 — достоверность различия изучаемого признака в сравнении с интактными клещами и клещами, окруженными основой препарата.
В 2010 г. R. Segal и соавт. [13] предложили в качестве диагностического инструмента использовать дерматоскоп, позволяющий увидеть клещей на поверхности кожного покрова. К бескровным методам исследования также относят стандартизированную биопсию поверхности кожи с дальнейшим изучением материала с помощью световой или электронной микроскопии [14—16]. Другие атравматичные методы исследования включают применение оптической когерентной томографии, позволяющей в режиме реального времени оценить состояние кожи пациентов в двух проекциях, и конфокальной лазерной сканирующей микроскопии поверхностных слоев кожи in vivo, с помощью которой можно получить объемное четырехмерное изображение [9, 13]. Преимуществами методов являются неинвазивность и комфорт пациента, а также их высокая информативность. Применение этих методов позволяет подтвердить эффективность лечения согласно имеющимся диагностическим критериям, а также выполнить подбор и свое временную корректировку врачебных назначений. В настоящее время терапию демодекоза проводят поэтапно, системно с включением противовоспалительных, антибактериальных, десенсибилизирующих и прочих препаратов, а также профилактических мероприятий [17].
Сложившиеся эмпирические представления о лечении демодекоза не в полной мере учитывают возможность этиологической терапии препаратами с акарицидным эффектом как в качестве монокомпонентной, так и в составе комплексной терапии. Это связано с тем, что в развитии данного заболевания могут играть роль не только нарушение функции гистогематических барьеров, но и проникновение продуктов жизнедеятельности паразитов в систему местной микроциркуляции крови. Снижение локальной иммунорезистентности обусловливает увеличение количества паразитов и возрастание их активности. Это в свою очередь может стать причиной скопления токсических веществ в сосудах микроциркуляции кожи, что снижает их эластичность, увеличивает проницаемость эндотелия и расширение сосудистой сети. Возникает местный ангионевротический отек, визуально выглядящий как розацеа. Поскольку этиология и патогенез демодекоза мало изучены, следует учитывать антипаразитарный эффект и нормализацию регуляции сосудистого компонента гистогематического барьера в качестве подходов к лечению.
В данном исследовании показан акарицидный эффект от применения препарата Д-18 и его компонентов, а также препарата сравнения (действующее вещество — ивермектин 1%) в эксперименте in vitro на клещах рода Demodex. Представленный на рынке препарат, содержащий ивермектин 1%, имеет такие противопоказания, как индивидуальная непереносимость, беременность, лактация, возраст до 18 лет, а также ряд побочных эффектов, таких как жжение, раздражение, зуд, сухость кожи, контактный и аллергический дерматит. Препарат ограничен в применении у пациентов с патологией печени.
По данным доклинических исследований, проведенных в компании АО «Ретиноиды», экспериментальный препарат Д-18 имеет низкую степень токсичности, что свидетельствует о его большей безопасности.
Заключение
В связи с предполагаемым включением в МКБ11 нового заболевания, вызванного клещами Demodex, актуальной задачей становится создание отечественного препарата с акарицидным эффектом в отношении вышеуказанных паразитов. Результаты настоящего исследования состава Д-18 in vitro продемонстрировали его выраженный противопаразитарный эффект в сравнении с имеющимся на рынке аналогом. Таким образом, концепция импортозамещения, проводимая в Российской Федерации, позволит реализовать создание нового конкурентоспособного отечественного лекарственного средства Д-18, обладающего акарицидным действием.
Д-18 и препарат сравнения (ивермектин 1%) вызывают гибель клещей рода Demodex через 2—2,5 ч от начала исследования. Статистически значимые различия в этих группах по отсутствию двигательной активности клещей в условиях настоящего эксперимента не выявлены.
Авторы заявляют об отсутствии конфликта интересов.
Литература
- Руководство по лабораторным животным и альтернативным моделям в биомедицинских исследованиях. Под ред. Каркищенко Н.Н., Грачева С.В. М. 2010;358.
- Национальный стандарт Российской Федерации (ГОСТ 33044-2014) «Принципы надлежащей лабораторной практики». М. 2015.
- Гутова В.П., Ноздрин В.И., Гузев К.С., и др. Способ оценки продолжительности жизни клещей Demodex folliculorum in vitro. Альманах «Ретиноиды». 2016;34:62-64.
- Руководство по проведению доклинических исследований лекарственных средств. Под ред. Миронова А.Н. В 2 частях. М. 2012.
- Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ. Под ред. Хабриева Р.У. М. 2005;832.
- Lacey N, Kavanagh K, Tseng SC. Under the lash: Demodex mites in human diseases. Biochemistry (London). 2009;31:2-6.
- Елистратова Л.Л. Клинико-микробиологические особенности акнеподобных дерматозов, осложненных демодекозом: Ди с. … канд. мед. наук. СПб. 2013;20.
- Камакина М.В. Акне у взрослых: Дис. … канд. мед. наук. М. 2002;27. Kamakina MV. Akne u vzroslykh: Dis. kand. med. nauk. М. 2002;27. (In Russ.).
- Митрошина Е.В. Оптический имиджинг в приложении к исследованию нейробиологических систем мозга. Электронное учебно-методическое пособие. Нижний Новгород. 2012;40.
- Whiting DA. Diagnostic and predictive value of horizontal sections of scalp biopsy specimen in male pattern androgenetic alopecia. J Am Acad Dermatol. 1993;28:755-763.
- Бутов Ю.С., Акилов О.Е. Клинические особенности и вопросы классификации демодекоза кожи. Российский журнал кожных и венерических болезней. 2003;2:53-58.
- Carly A, Elston BА, Dirk M, Elston MD. Demodex mites. Clin Dermatol. 2014;32:739-743. https://doi.org/10.1016/j.clindermatol.2014.02.012
- Segal R, Mimouni D, Feuerman H, Pagovitz O, David M. Dermoscopy as a diagnostic tool in demodicidosis. Int J Dermatol. 2010;49(9):1018-1023. https://doi.org/10.1111/j.1365-4632.2010.04495.x
- Casas C, Paul C, Lahfa M, Livideanu B, Lejeune O, Alvarez-Georges S, Saint-Martory C, Degouy A, Mengeaud V, Ginisty H, Durbise E, Schmitt A.M, Redoulès D. Quantification of Demodex folliculorum by PCR in rosacea and its relationship to skin innate immune activation. Exp Dermatol. 2012; 21(12):906-910. https://doi.org/10.1111/exd.12030
- Forton F. Standardized skin surface biopsy: method to estimate the Demodex folliculorum density, not to study the Demodex folliculorum prevalence. J Eur Acad Dermatol Venereol. 2007;21:1301-1302. https://doi.org/10.1111/j.1468-3083.2007.02455.x
- Yun CH, Yun JH, Baek JO, Roh JY, Lee JR. Demodex mite density determinations by standardized skin surface biopsy and direct microscopic examination and their relations with clinical types and distribution patterns. Ann Dermatol. 2017;29(2):137-142. https://doi.org/10.5021/ad.2017.29.2.137
- Верхогляд И.В. Современные представления о демодекозе. Лечащий врач. 2011;5:34-35.
Источник:
© "Издательство Медиа Сфера" www.mediasphera.ru
Журнал "Клиническая дерматология и венерология ", 2019. № 2. стр. 160–164.






Не забудьте вступить в наши группы в социальных сетях!