
Авторы: Г. А. Пьявченко1,2, В. А. Пугач3, Н. С. Новикова3, Л. И. Шмаркова4, Е. А. Корнева3, В. И. Ноздрин1,2
1 Кафедра гистологии, цитологии и эмбриологии (зав. – проф. В. И. Ноздрин), Медицинский институт, Орловский государственный университет имени И. С. Тургенева;
2 Научный отдел (руков. – канд. биол. наук Г. В. Трунова), Фармацевтическое научно-производственное предприятие «Ретиноиды», Москва;
3 Отдел общей патологии и патофизиологии (зав. – д.б.н. О. В. Шамова), ФГБНУ «Институт экспериментальной медицины»;
4 Кафедра математики, информатики и информационных технологий (зав. – проф. Л. И. Малявкина), Орловский государственный университет экономики и торговли.
Выявление c-Fos позитивных нейронов в различных участках головного мозга и изучение поведенческих реакций лабораторных крыс в условиях накожного нанесения пасты с содержанием 5% антисептика-стимулятора Дорогова 3 фракции показало активацию нейронов цингулярной, моторной, пириформной коры и стриатума, увеличение двигательной и ультразвуковой активности, а также продемонстрировало наличие корреляционной зависимости поведенческих реакций от активации нейронов в изучаемых зонах мозга. Результаты свидетельствуют о совместной регуляции поведения многими структурами мозга и о наличии у Препарата нейротропного эффекта.
Ключевые слова: цингулярная, моторная, пириформная кора, стриатум, антисептик-стимулятор Дорогова, c-Fos, поведенческие реакции.
Упоминания об антисептике-стимуляторе приходятся на первую половину прошлого века, когда он был получен А. В. Дороговым путем глубокого термического разложения тканей животных (АСД). По результатам проведенных исследований на животных и человеке был описан широкий положительный фармакологический эффект, охватывающий в том числе заболевания кожи (экзема, нейродермит, псориаз, аллергодерматозы и др.). При этом отмечен общий стимулирующий эффект на нервную систему [3]. Фармакологическая характеристика фракций препарата подтверждала данные о влиянии АСД на нервную систему, указывая на мускарино-, никотино- и холиномиметический эффект от нанесения препарата [1]. Морфологические проявления этого эффекта изучены не были. Известно, что поведенческие акты регулируются взаимодействием многих структур мозга. Основываясь на данных литературы [16, 21], были выбраны следующие функциональные зоны мозга: цингулярная кора – ответственна за сложные поведенческие реакции и ультразвуковые вокализации, моторная – регулирует четкие, избирательные движения, лежащие в основе поведения, соматосенсорная – чувствительность от большинства рецепторов тела, инсулярная – ответственна за процесс принятия решений, эмоциональный контроль за поведением и является центром регуляции зависимости от наркотических веществ, пириформная кора ответственна за эмоциональный контроль за поведением и стриатум, который участвует в регуляции сложных поведенческих актов, в работе внутренних органов. Для гистологической оценки степени активации нейронов мозга в настоящее время используют определение содержания белка c-Fos (маркер ранней нейральной активации) [8, 10, 11, 20].
Целью настоящего исследования стало изучение морфологических изменений нервных клеток в коре и стриатуме головного мозга крыс после накожного нанесения цинковой пасты с 5% АСД 3 фракции (Препарат). В связи с этим были поставлены следующие задачи:
Исследование проводили на крысах-самцах линии Sprague Dawley массой 100-120 г. (n=6 в группе), полученных из питомника филиала ИБХ РАН «Пущино». Животных содержали в условиях вивария Центра доклинических исследований АО «Ретиноиды». Основные правила содержания и ухода за крысами соответствовали правилам по устройству, оборудованию и содержанию вивариев [4]. Процедуры по уходу за животными выполняли в соответствии со стандартными операционными процедурами. Крысы находились в контролируемых условиях окружающей среды и получали полнорационный гранулированный комбикорм и очищенную воду без ограничений. Перед исследованием животных помещали в отдельное помещение на период адаптации в течение 14 дней. После рандомизации и идентификации крыс разделяли на следующие группы: группа 1 – интактные животные; группа 2 – животные, получавшие основу препарата (цинковая паста) и группа 3 – животные, получавшие Препарат. Животным 2 и 3 групп выбривали участок межлопаточной области спины площадью 4 см2. Основу и препарат в дозе 2 г/кг наносили 2 раза в сутки в течение 7 дней. Через 2 часа после последнего нанесения в течение 15 минут проводили запись двигательной активности, ультразвуковых вокализаций (УЗВ) и надпороговых криков на синхронизированном по времени комплексе Laboras-Sonotrack (Metris, Нидерланды) [6]. В дальнейшем животных наркотизировали препаратом Золетил 100 (Virbac, Франция). После интракардиальной перфузии иммунофикса (Bio-Optica, Италия) головной мозг фиксировали в течение часа и переносили в 15% раствор сахарозы на иммунофиксе. Срезы толщиной 40 µm получали на микротоме Thermo Scientific HM430 (Microm GmbH, Германия) с устройством быстрого замораживания KS 34. C-Fos-позитивные (активированные) клетки выявляли авидин-биотиновым методом с детекцией 3,3’-диаминобензидином (Santa Cruz, США).
Объектами исследования служили цингулярная, моторная, соматосенсорная, инсулярная, пириформная кора и стриатум (Рис. 1), соответствующие 13-17 уровням срезов мозга по атласу Paxinos and Watson [15]. Подсчёт c-Fos-позитивных клеток проводили в 3 полях зрения для каждого животного (об. 40, ок., 20) при помощи программного обеспечения AxioVision (Carl Zeiss, Германия) на микроскопе Axioskop 2 (Carl Zeiss, Германия). Статистический анализ достоверности различий средних величин (M±m, t-критерий Стьюдента), а также анализ корреляционной зависимости поведенческих реакций от количества нейронов (коэффициент корреляции r) проводили с помощью программы Statistica, версия 6,1 [7].
Экспрессия гена c-Fos была выявлена в фоновом количестве у крыс из 1-й группы. У животных из 2-й группы наблюдалось большее количество c-Fos-позитивных нейронов, в особенности – в моторной и соматосенсорной коре. Крысы, получавшие Препарат, показали резкое увеличение количества активированных нейронов во всех исследуемых зонах (рис. 4), особенно, в цингулярной, моторной, пириформной коре и стриатуме (рис. 2-3). Результаты анализа поведенческой активности крыс после применения Препарата демонстрируют увеличение продолжительности и скорости движения, пройденного расстояния, а также общего количества зарегистрированных поведенческих актов (табл. 1). Анализ показателей УЗВ показал, что крысы из 3-й группы издают ультразвуков больше и ниже – по частоте (табл. 2). Корреляционный анализ в группе животных, получавших Препарат, выявил наличие достоверной зависимости между числом c-Fos-позитивных нейронов и поведенческой активностью крыс (табл. 3).
В настоящем исследовании обнаружена связь между активацией нейронов моторной, пириформной коры и стриатума головного мозга крыс и их средней скоростью движения, что подтверждает наличие кортико-стриальных и кортико-кортикальных взаимодействий головного мозга. Эти данные согласуются с результатами исследований на лабораторных грызунах, обобщенных в монографии C. Watson, G. Paxinos и L. Puelles [21]. Наличие подобных связей в своих работах описывают и другие авторы [13, 19]. Корреляционный анализ выявил наличие связи между количеством активированных нейронов моторной, пириформной коры и стриатума и двигательной активностью лабораторных крыс. Этот факт подтверждает многочисленные литературные данные о связях коры и подкорковых ядер головного мозга в осуществлении двигательных актов и их регуляции [2, 5, 12, 14]. В работе показано, что накожное нанесение Препарата сопровождается активацией нейронов стриатума, цингулярной, моторной и пириформной коры и изменением в поведении. A. Sayin и др. [18] в своем исследовании отмечают, что введение крысам-самкам циталопрама коррелирует с тревожным поведением и увеличением содержания c-Fos позитивных нейронов в цингулярной коре, миндалевидном теле и паравентрикулярном таламическом ядре. О том же говорят результаты исследования O. Babaev и др. [9], согласно которым, воздействие на белки нейролигины приводит к активации c-Fos-позитивных нейронов в зонах, ассоциирующихся с тревогой.
В нашем исследовании выявлена корреляционная связь между количеством c-Fos-позитивных нейронов цингулярной коры и параметрами ультразвуковых вокализаций в группе животных, получавших Препарат. В статье S. S. Pertsov и др. [17] также отмечено, что различные эмоциональные состояния у крыс сопровождаются изменениями параметров УЗВ, регистрируемых комплексом Sonotrack. Увеличение содержания индуцибельного белка c-Fos в соматосенсорной и инсулярной коре свидетельствует об активации нейронов в ответ на процесс накожного нанесения Препарата и связанными с этим ощущениями.
Нанесение цинковой пасты с 5% АСД 3 фракции на кожу межлопаточной области крыс линии Sprague Dawley приводит к значительному увеличению числа активированных, c-Fos-позитивных нейронов в цингулярной, моторной, инсулярной и пириформной коре, а также – в полосатом теле головного мозга и к увеличению двигательной и ультразвуковой активности крыс. Результаты корреляционного анализа позволяют говорить о высокой степени вероятности наличия связи между количеством активированных нейронов и поведенческой активностью животного.
| Показания прибора Laboras | ||||
|---|---|---|---|---|
| Группы | Продолжительность двигательных актов, сек | Средняя скорость движения, мм/с | Пройденное расстояние, м | Общее количество поведенческих актов |
| Интактные животные | 6,5±2,7 | 0,4±0,2 | 0,3±0,2 | 155±33,5 |
| Основа | 40,2±1,2* | 2,9±0,4* | 2,6±0,3* | 329,7±15,2* |
| Цинковая паста с 5% АСД-3 | 74,5±10,5*, # | 6,5±0,7*, # | 5,9±0,6*, # | 413,3±13,1*, # |
* P≤0,05, по сравнению с 1 группой
# P≤0,05, по сравнению со 2 группой
| Показания прибора Sonotrack | |||
|---|---|---|---|
| Группы | Количество криков | Количество надпороговых криков | Средняя частота криков, Гц |
| Интактные животные | 9,3±4,2 | 0 | 49364±47,4 |
| Основа | 6,7±1,5 | 1,7±0,7* | 49190,7±149,6 |
| Цинковая паста с 5% АСД-3 | 49,3±7,4*, # | 19±4,9*, # | 48512,3±78*, # |
* P≤0,05, по сравнению с 1 группой
# P≤0,05, по сравнению со 2 группой
| Зоны головного мозга | Параметры поведения | Коэффициент корреляции (r) |
|---|---|---|
| Моторная кора | Средняя скорость движения, мм/с | 0,92 |
| Стриатум | 0,92 | |
| Пириформная кора | 0,92 | |
| Цингулярная кора | Крики | 0,94 |
| Средняя частота криков, Гц | -0,92* | |
| Надпороговые крики | 0,91 |
* – указывает на обратную корреляционную зависимость.
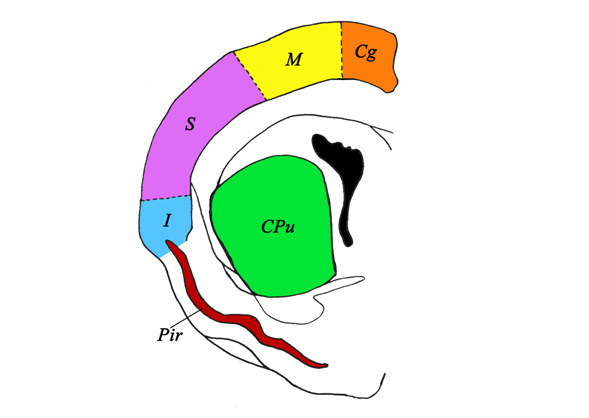
Рис 1. Схема строения коры и стриатума правого полушария головного мозга крысы. Фронтальный срез на 13-17 уровнях. Обозначения структур, в которых выявлены c-Fos-позитивные нейроны: цингулярная (cingularis) – Cg; моторная (motorius) – M; соматосенсорная (somatosensorius) – S; инсулярная (insularis) – I; пириформная кора (cortex piriformis) – Pir и стриатум (corpus striatum) – CPu. Рисунок Сень Е. В.

Рис 2. А.

Рис 2. Б.
Микрофотографии фрагментов моторной коры крыс из 2-й (А) и 3-й групп (Б) эксперимента, c-Fos-позитивные клетки разной интенсивности окраски указаны стрелками. Об. 40х, ок. 20х.

Рис 3. А.
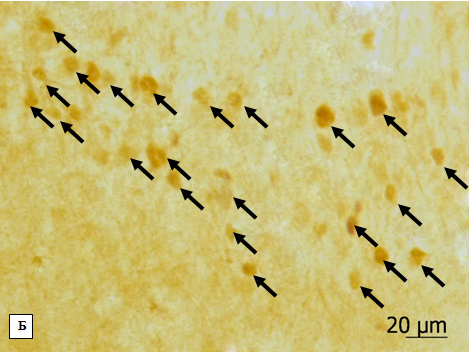
Рис 3. Б.
Микрофотографии фрагментов пириформной коры крыс из 2-й (А) и 3-й групп (Б) эксперимента, c-Fos-позитивные клетки разной интенсивности окраски указаны стрелками. Об. 40х, ок. 20х.
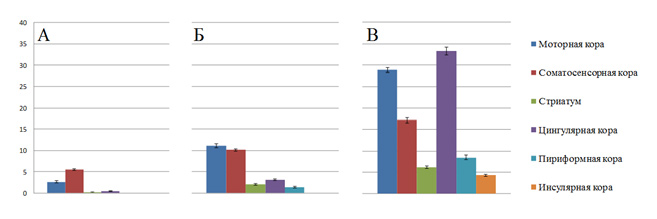
Рис 4. Количество c-Fos позитивных клеток в п. з. коры головного мозга и базальных ядер (стриатум) интактных крыс (А); крыс, получавших основу (Б) и крыс, получавших цинковую пасту с 5% АСД-3 (В). По оси ординат – среднее количество активированных нейронов в поле зрения (M), вертикальными отрезками столбиков обозначена стандартная ошибка среднего (m).
Не забудьте вступить в наши группы в социальных сетях!